高中化学
材料一《普通高中化学课程标准(实验)》关于氧化还原反应的内容标准:根据实验事实
了解氧化还原反应的本质是电子的转移,举例说明生产、生活中常见的氧化还原反应。
材料二某版本高中教科书《化学l》中“氧化还原反应”的部分内容如下。


材料三教学对象为高中一年级学生,他们已经学习了物质的分类、化合价的相关知识。
要求:
(1)请回答第1个思考与交流中的问题2。(2分)
(2)请完成“氧化还原反应”的教学设计,内容包括教学目标、教学方法、教学过
程(不少于300字)。(28分)
(2)教学设计
【教学目标】
①能够从得失氧、化合价升降和电子转移三个角度认识氧化还原反应;了解氧化还原反应的本质是电子转移。
②通过实例复习氧化反应和还原反应,产生认知冲突,从得失氧角度,初步认识氧化还原反应的概念;学会用辩证的思维去看待化学反应,初步建立氧化还原反应概念的认知模型。
③思考化合价变化的原因,进而深入探究氧化还原反应本质,完善氧化还原反应概念,建立化合价升降和电子转移两个氧化还原反应判据间的关联,从宏观结合的层面形成氧化还原反应概念认知模型。
④以不同的分类标准理解氧化还原反应的概念,形成看待问题的全面视角观;通过对“氧化”和“还原”这一对典型矛盾的深入研究,深刻体会自然现象中的对立与统一关系,树立辩证唯物主义思想。
【教学方法】
讲授法、谈话法等。
【教学过程】
环节一:新课导入

高;失氧的元素发生还原反应,元素化合价降低”的结论,进而讲授氧化还原反应的特征,即有元素化合价的升降。
3.教师以铁与硫酸铜的反应为例说明并不是只有得失氧的化学反应才是氧化还原反应。
4.教师带领学生共同总结新的化学反应的分类方法,即从反应物变成产物时元素的化合价是否发生了变化来分类,一类是元素的化合价有变化的反应,即氧化还原反应,如
(二)氧化还原反应的本质
1.教师提出问题:为什么氧化还原反应前后元素的化合价发生了变化?其本质原因是什么?
2.教师利用多媒体展示一些元素的原子结构示意图(教材图2—10)及金属钠与氯气发生反应生成氯化钠的示意图(教材图2-11),进而从电子得失的角度讲解金属钠和氯气反应生成氯化钠的过程说明:元素化学价的变化与得失电子(电子转移)有关。
3.教师以反应
为例,讲授在该反应过程中,元素之间只有共用电子对的偏移,且因共用电子对偏离于氢原子,而偏向于氯原子,故氢元素的化合价由0价升高到+1价,被氧化,氯元素的化合价由0价降低N-1价,被还原,从而引导学生得出结论:共用电子对的偏移也可以使元素化合价发生变化。
4.教师引导学生根据上述结论从电子转移的角度重新定义氧化还原反应:有电子转移(得失或偏移)的反应,是氧化还原反应。
环节三:巩固提升
教师指导学生分小组交流讨论:从得失氧的观点、化合价升降的观点以及电子转移的观点对氧化反应与还原反应以及它们的关系等做出总结,如下表所示。
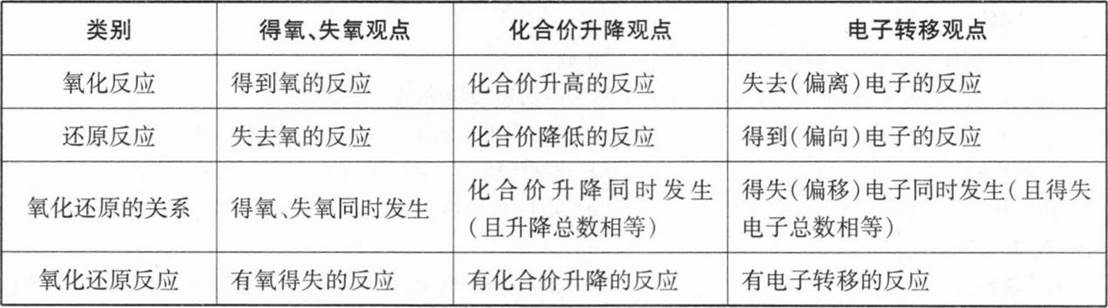
环节四:小结作业
1.小结:学生归纳总结本节课所学主要知识,表述学习心得。
2.作业:课下思考四大反应类型与氧化还原反应有什么关系。
你可能感兴趣的试题
A.使用共享快递盒以节约木材师
B.使用风力发电减少CO2排放
C.秸秆就地焚烧以降低运输成本
D.推广共享单车减少尾气污染照
A.甲烷分子的球棍模型
B.NH4Br的电子式
C.S2的结构示意图
D.邻羟基苯甲酸的结构简式
A.CO2和CaO
B.CaCl2和Na2S
C.NaCI和NH4CI
D.HCI和NaOH
最新试题
阅读下列材料,根据要求完成任务。 材料一普通高中***课程标准关于糖类的内容标准是:结合实例认识糖类在生产、生活中的重要
阅读案例,并回答问题。 下面是某教师关于" 化学反应的限度”的教
某化学教师在- -次化学测验中设计了下列试题,并**生 的解题结果进行了统计和分析。
阅读下面素材,回答有关问题: 1884年,阿累尼乌斯提交了关于电解质理论的**论文。论文长达150页,列出了全部参考文献
阅读下面文字,回答有关问题: 化学教学原则对**的教学工作具有重要指导意义。化学教学的主要原则之一是“ 教为
No表示阿伏伽德罗常数的值,下**正确的是( )。
实验室处理含FeBrs的废液,得到溴的苯溶液和无水FeCl3.下列设计能***达到相应实验目的的是( )。
下列实验现象或事实的***化学原理相同的是( )师
在给定条件下,下列选项所表示的物***质间转化均能实现的是( )。
下列各组化合物中,所含化学键类***型完全相同的是( )。
