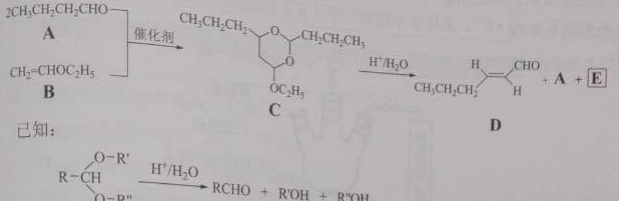
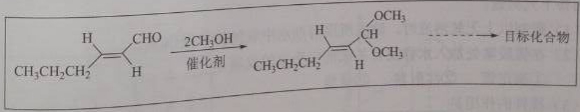
理综
|
碳 |
氮 |
Y |
|
|
X |
|
硫 |
Z |
回答下列问题
(1)Z元素在周期表中的位置为__________。
(2)表中元素原子半径最大的是(谢元素符号)__________。
(3)下列事实能说明Y元素的非金属性比S元素的非金属性强的是__________;
a.Y单质与H2S溶液反应,溶液变浑浊
b.在氧化还原反应中,1molY单质比1molS得电子多
c.Y和S两元素的简单氢化物受热分解,前者的分解温度高
(4)X与Z两元素的单质反应生成1molX的最高价化合物,恢复至室温,放热687kJ,已知该化合物的熔、沸点分别为-69℃和58℃,写出该反应的热化学方程式__________。
(5)碳与镁形成的1mol化合物Q与水反应,生成2molMg(OH)2和1mol烃,该烃分子中碳氢质量比为9:1,烃的电子式为__________。Q与水反应的化学方程式为__________。
(6)铜与一定浓度的硝酸和硫酸的混合酸反应,生成的盐只有硫酸铜,同时生成的两种气体均由表中两种气体组成,气体的相对分子质量都小于50.为防止污染,将产生的气体完全转化为最高价含氧酸盐,消耗1L2.2mol/LNaOH溶液和1molO2,则两种气体的分子式及物质的量分别为__________,生成硫酸铜物质的量为__________。
(1)第三周期,ⅦA族
(2)Si
(3)ac
(4)Si(s)+2Cl2(g)=SiCl4(l) △H=−687 kJ/mol
(5)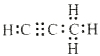 ;Mg2C3+4H2O=2 Mg(OH)2+C3H4↑
;Mg2C3+4H2O=2 Mg(OH)2+C3H4↑
(6)NO 0.9 mol;NO2 1.3 mol;2 mol
你可能感兴趣的试题
最新试题
24.小明设计的电磁健身器的简化装置如图所示,两根平行金属导轨相距l=0.50m,倾角θ=53°,导轨上端串接一
23.(16分)在真空环境内探测微粒在重力场中能量的简化装置如图所示。P是一个微粒源,能持续水平向右发射质量相同
20.如图所示为赛车场的一个“梨形”赛道,两个弯道分别为半径R=90m的大圆弧和r=40m的小圆弧,直道与弯道相
D.A、B两球连续中点处的电场强度为0
二、选择题(本大题共3小题。在每小题给出的四个选项中,至少有一个选项是符合题目要求的。全部选对的得6分,选对但不全的
17.如图所示为一种常见的身高体重测量仪。测量仪顶部向下发射波速为v的超声波,超声波经反射后返回,被测量仪接收,
16.如图所示,a、b两个闭合正方形线圈用同样的导线制成,匝数均为10匝,边长la=3lb,图示区域内有垂直纸面
15.如图所示,两个不带电的导体A和B,用一对绝缘柱支持使它们彼此接触。把一带正电荷的物体C置于A附近,贴在A、
14.以下说法正确的是 A.在静电场中,沿着电场线方向电势逐渐降低 B.外力对物体所做的功越多,对应
13.为落实“五水共治”,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO